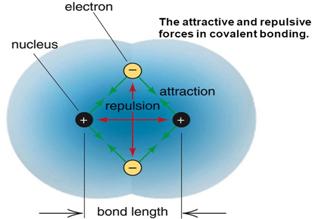
· Khi các nguyên tử sinh hoạt thật cách nhau tiến cho gần nhau tương tác trước tiên xuất hiện tại là liên tưởng hút, mang lại một khoảng cách nhất định bước đầu xuất hiện liên hệ đẩy, khi bao gồm sự thăng bằng giữa nhị lực thì liên kết hóa học hình thành.
· liên kết hóa học tập hình thành tương ứng với những nguyên tử phải thu xếp lại kết cấu e các phân phần bên ngoài cùng thế nào cho đạt tổng tích điện chung của hệ nên hạ phải chăng xuống thì links mới bền, nghĩa là khi có sự sinh sản thành liên kết thì quy trình phát nhiệt (ΔH
2. Bản chất liên kết hóa học:
· links hóa học tập có bản chất điện vì cơ sở sản xuất thành liên kết là lực xúc tiến giữa các hạt với điện (e tích điện âm – hạt nhân tích điện dương).
Bạn đang xem: Năng lượng liên kết hóa học
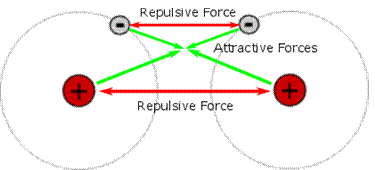
Hình 4.1. Can hệ giữa các hạt sở hữu điện
· trong những tương tác hóa học chỉ có những e của rất nhiều phân phần bên ngoài cùng thực hiện liên kết, sẽ là các e hóa trị. Những e hóa trị phía bên trong các AO hóa trị.
· Theo cơ học tập lượng tử, nghiên cứu liên kết là phân tích sự phân bố tỷ lệ e trong trường phân tử nhân của những nguyên tử tạo cho hợp chất.
3. Một số đặc trưng của liên kết:
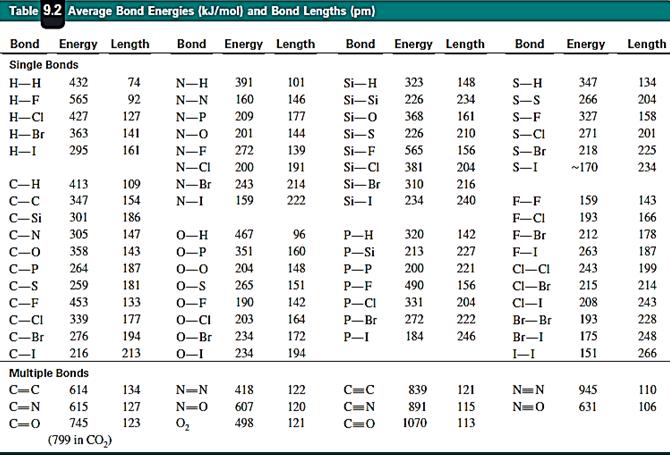
Những thông số chính đặc trưng cho phân tử với cho links là độ lâu năm liên kết, góc hóa trị và năng lượng liên kết.
v Độ dài liên kết (l):
 |
v Góc hóa trị (góc liên kết):
Là góc hợp vì chưng hai đoạn trực tiếp nối phân tử nhân nguyên tử trung vai trung phong với nhì hạt nhân nguyên tử liên kết. Góc hóa trị đổi khác có qui chế độ và dựa vào vào:

Ø bản chất nguyên tử.
Ø mẫu mã liên kết. (H3C─CH3: CĈH = 109028’);
(H2C═CH2: CĈH = 1200); (HC≡CH: CĈH = 1800)
Ø những thiết kế học phân tử.
Ø liên hệ đẩy giữa những đôi electron liên kết và không links trong phân tử.
v Năng lượng liên kết:
Là năng lượng cần tiêu hao để tiêu diệt liên kết thành những nguyên tử xa lánh ở thể khí (hay cũng đó là năng lượng giải phóng ra khi sản xuất thành links từ những nguyên tử xa lánh thể khí lúc đầu ).
A─B(k) + EA─B A(k) + B(k) => EA─B = Ephân ly AB
ABn(k) + EABn A(k) + nB(k) => ĒA─B =
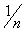
Năng lượng liên kết nhờ vào vào độ dài liên kết, độ bội liên kết (bậc liên kết) và chất lượng độ bền liên kết. Người ta phân biệt :*Bậc lk↑, E lk↑, thời gian chịu đựng lk↑, độ dài lk↓. *
II- LIÊN KẾT CỘNG HÓA TRỊ :
Có hai cách thức gần đúng để giải phương trình sóng Schrödinger đến hệ phân tử, mỗi phương thức do một nhóm tác giả giới thiệu hình thành một thuyết về link cộng hóa trị :
· Thuyết liên kết hóa trị (VB: valence bond theory) (Heitler–London–Pauling): coi hàm sóng phân tử là tích số các hàm sóng nguyên tử.
· Thuyết orbital phân tử (MO: molecule orbital theory) (Mulliken): xem hàm sóng phân tử là phép tổ hợp cộng cùng trừ các hàm sóng nguyên tử.
1. Thuyết liên kết hóa trị (phương pháp VB)
a. Phân tử H2 : Xét hệ
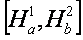
Ø Phương trình sóng Schrödinger viết cho hệ trên:
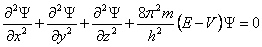
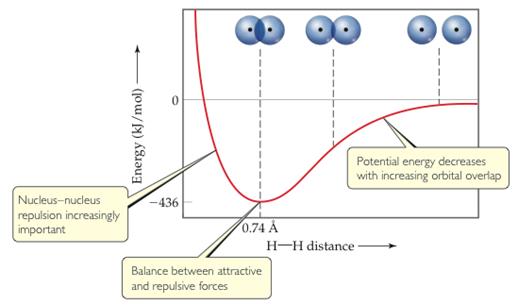
· cùng với V là nạm năng của hệ (theo quy ước: khi không có tương tác cụ năng = 0, có can dự hút cụ năng giảm yêu cầu mang vết âm, có cửa hàng đẩy nắm năng tăng phải mang vệt dương)
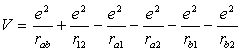
· Khi nhì nguyên tử ở cách nhau vô cùng, chỉ có shop giữa e và hạt nhân của từng nguyên tử H riêng lẻ. Cơ hội đó sự chuyển động của e được mô tả bằng hàm sóng của từng nguyên tử H:
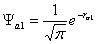
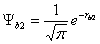
· Một bí quyết gần đúng, xem hàm sóng Ψ của hệ
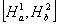
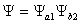
· Khi nhì nguyên tử H tiến mang lại gần nhau: e1 không chỉ là chịu lực hút của hạt nhân a bên cạnh đó chịu lực hút của phân tử nhân b, với e2 thì ngược lại. Do vậy hàm sóng được bổ sung thêm một đại lượng tương đương là:
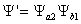
Nói phương pháp khác từ bây giờ hai nguyên tử gồm sự đàm phán electron với nhau cần hàm sóng Ψ của hệ là:
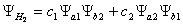
· cố kỉnh
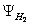
kết quả có 2 hàm sóng đặc trưng cho trạng thái của những e trong hệ trên:
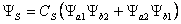
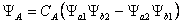
· Ý nghĩa đồ dùng lý:
o ΨS – hàm đối xứng : tương ứng với 2 e thảo luận có spin ngược dấu nhau nên hút nhau làm tỷ lệ e trong vùng không khí giữa hai hạt nhân tạo thêm → lực hút ngày càng tăng nên liên kết được hình thành.
o ΨA – hàm bất đối xứng : tương xứng với 2 e dàn xếp có spin cùng dấu nhau buộc phải đẩy nhau làm mật độ e trong vùng không gian giữa nhị hạt nhân triệt tiêu → phải liên kết không hình thành.
*Liên kết giữa các nguyên tử H được chế tác thành như trên hotline là link cộng hóa trị.
Xem thêm: 【Full Skill】Cách Viết Mẫu Sơ Yếu Lý Lịch Xin Việc Làm, 404 Not Found
Luận điểm cơ phiên bản của phương pháp VB về link cộng hóa trị:Ø vấn đề 1: links cộng hóa trị hình thành trên cơ sở những cặp e ghép đôi gồm spin ngược lốt nhau và thuộc về bên cạnh đó cả nhì nguyên tử tương tác. Vì vậy, links cộng hóa trị còn được gọi là liên kết hai vai trung phong – hai năng lượng điện tử.
Ø

Ø vấn đề 3: liên kết cộng hóa trị càng bền khi tỷ lệ e vùng xen đậy giữa những AO càng lớn. Độ xen phủ dựa vào vào kích thước, làm nên và hướng xen phủ của những AO hóa trị.
c. Kỹ năng tạo links cộng hóa trị của nguyên tử cùng tính bão hòa link cộng hóa trị:
Ø Cơ chế tạo liên kết cộng hóa trị:
· nguyên tắc ghép đôi:
Liên kết cùng hóa trị được hình thành vày sự xen che của 2 AO hóa trị đựng e đơn chiếc của 2 nguyên tử tương tác. Cặp e ghép đôi bởi hai nguyên tử bỏ ra.
· phương pháp cho nhận:
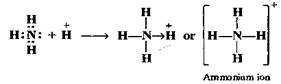
Liên kết cộng hóa trị hình thành vị một nguyên tử solo phương chi ra cặp e hóa trị dùng chung (nguyên tử cho) còn nguyên tử kia dìm cặp e này.
Điều kiện tạo link cho nhận: nguyên tử mang lại phải bao gồm AO hóa trị chứa cặp e ghép đôi ; nguyên tử dấn phải có AO hóa trị trống.
Ø Khả năng tạo link cộng hóa trị của một nguyên tử (theo cả nhì cơ chế) được đưa ra quyết định bởi số AO hóa trị (AO trống, AO đựng electron độc thân và AO cất cặp electron ghép đôi) chứ không phải phụ thuộc vào số e hóa trị .Kết quả ta có:
| Nguyên tử của | PL e hóa trị | Số AO hóa trị | Số link cht về tối đa |
| CKI | 1s | 1 | 1 |
| CKII | 2s 2p | 4 | 4 |
| CKIII | 3s 3p 3d | 9 | 9 |
| Nguyên tố d | ns (n-1)d np | 9 | 9 |
TD:Trong những phân tử hoặc ion dưới đây có hệ nào không tồn tại: CF4, CF62-, SiF4, SiF62-, OF2, OF62- . Đáp : CF62-, OF62- .
Ø Điều khiếu nại tạo link cộng hóa trị:
o năng lượng của các AO gia nhập xen tủ phải xê dịch nhau.
o những AO tham gia xen phủ yêu cầu có tỷ lệ e đầy đủ lớn.
o những AO tham gia xen phủ phải cùng tính định hướng.
Ø Biểu diễn links cộng hóa trị: H : H hoặc H – H
d. Những loại links cộng hóa trị với bậc của link cộng hóa trị:
Ø Liên kết s (sigma): có 1 vùng xen phủ của những AO nằm trên trục nối nhị hạt nhân. Liên kết σ bền với là liên kết cộng hóa trị trước tiên giữa 2 nguyên tử. Rất có thể xuất hiện tại giữa tất cả các nhiều loại AO: s – s, p. – p, s – p, s – d, p. – d …
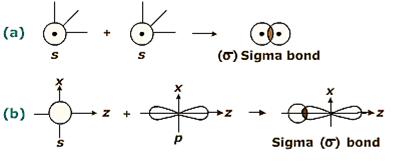
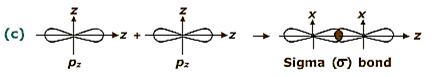
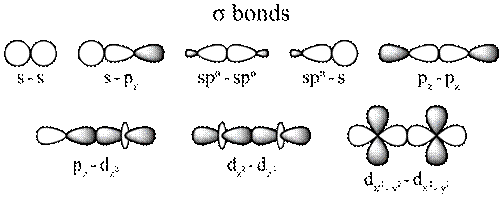
Hình 4.3. Các loại liên kết sigma
Ø Liên kết p (pi): có hai vùng xen phủ của những AO ở ở phía 2 bên trục nối nhì hạt nhân. Trường hòa hợp này thường tương ứng với sự đậy phủ p. – p, d – d, p. – d… Do mật độ e xen phủ nhỏ hơn nên liên kết p kém bền lâu s. Liên kết p chỉ hình thành sau khi giữa hai nguyên tử đã có liên kết s.
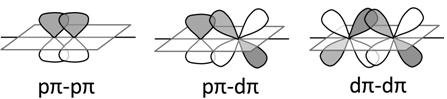
Hình 4.4. Những loại liên kết pi
Ø Liên kết d (delta): hình thành do 2 AO d cùng tính đối xứng nằm trong hai phương diện phẳng tuy vậy song xen lấp lẫn nhau hàng loạt cả 4 múi. Liên kết δ cũng nhát bền.
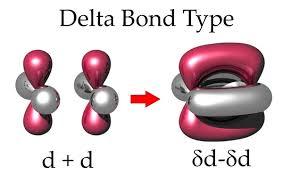
Hình 4.5. Link Delta
Ø Liên kết p không định chỗ: Là liên kết π mà những electron π không thắt chặt và cố định ở các nguyên tử lúc đầu đã bỏ ra, bọn chúng xoay quanh trên một số hạt nhân nhiều hơn nữa hoặc cả phân tử. Gần như hệ có liên kết π không định chỗ thông thường có bậc links không nguyên.
Ví dụ: C6H6: gồm 3 đặc điểm cấu tạo: (i) toàn cục 12 nguyên tử nằm trên một phương diện phẳng. (ii) toàn bộ các góc links đều bởi 1200. (iii) Độ dài 6 liên kết C-C đều nhau và có giá trị chính giữa C─C và C═C.
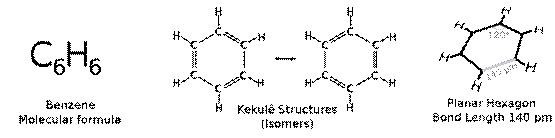
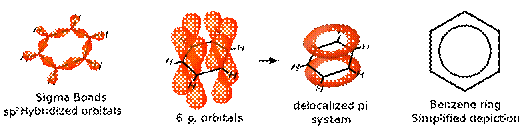
Bậc links (C ÷ C) = 1,5
*Bậc liên kết cộng hoá trị: là mốc giới hạn lặp lại links giữa nhị nguyên tử. Bậc liên kết rất có thể không nguyên (TD: BF3 là 1,33; NO2 là 1,5; CO32- cùng SO32- là 1,33; butadien-1,3 là 1,67…)
Cách tính bậc link cộng hóa trị theo thuyết VB (có 2 cách):
Bậc liên kết = 1σ + (số lk π ⁄ số lk σ) = ½(Tổng số e lk ⁄ số lk σ)
TD: CH2=CH─CH=CH2 . Blk= 1σ + 2π /3σ = ½(5lk.2 /3σ) = 1,67
e. đặc điểm của liên kết cộng hóa trị:
Tính chất đặc trưng của links cộng hóa trị là:
v Tính bão hòa: bởi vì mỗi nguyên tố hóa học chỉ có một số giới hạn AO hóa trị bắt buộc số link cộng hóa trị có thể tạo được cũng có giới hạn. Đó là tính bão hòa của liên kết cộng hóa trị (ngược lại: với liên kết ion, liên kết kim loại thì ko bão hòa).
v Tính có cực:
Ø Tính tất cả cực của links cộng hóa trị: Đôi năng lượng điện tử trong liên kết cộng hóa trị có thể bị lệch về phía nguyên tử có độ âm điện bự hơn, đó là sự phân rất của link cộng hóa trị. Đám mây e lệch về phía nguyên tử gồm độ âm điện lớn hơn làm nguyên tử này tích năng lượng điện âm d-, nguyên tử tê tích năng lượng điện dương d+


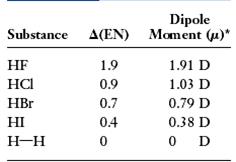


Sự phân rất làm xuất hiện lưỡng rất điện gồm hai tâm bao gồm điện tích trái dấu (d+, d- ) , nằm giải pháp nhau một khoảng chừng l (gọi là độ dài lưỡng rất = độ lâu năm liên kết). Lưỡng cực này được đặc thù bằng vectơ momen lưỡng cực m .
Moment lưỡng rất m: là đại lượng vectơ bao gồm chiều quy ước từ cực dương mang đến cực âm.
|m| = |q|l = del . (D = debye)
Ø Tính tất cả cực của phân tử cùng hóa trị :được tính bởi phép tổng các vectơ momen lưỡng rất của toàn bộ các link và của những đôi không links trong phân tử. Kết quả là có các phân tử cộng hóa trị không cực như H2, O2, N2,… hoặc các phân tử gồm tính đối xứng trong không khí (CO2, BeCl2, BF3, CH4, CCl4, SiF4, NH4+, C2H2, C2H4, C2H6, C6H6 ...) bao gồm m = 0. Các phân tử cùng hóa trị gồm cực thường là các phân tử bất đối xứng trong không khí ( SO2, NO2, NH3, H2O, CH3Cl, CH2Cl2…). Tính có cực của phân tử cùng hóa trị ảnh hưởng gần như đưa ra quyết định đến năng lực hòa tan với hóa lỏng của chúng:
¨ Hòa tan: những chất bao gồm cực thì tan tốt trong dung môi có cực (H2O, C2H5OH, CH3COOH, CHCl3, (C2H5)2O, (CH3)2CO…); những chất không cực tan xuất sắc trong dung môi không cực (CCl4, CS2, C6H6, n- C6H14, xylen…)
¨ Hóa lỏng: các chất có cực (NH3, CH3Cl…)dễ hóa lỏng hơn các chất không cực
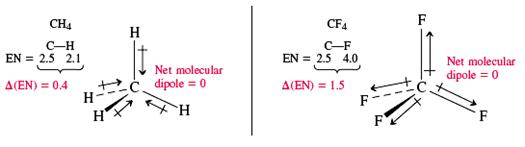

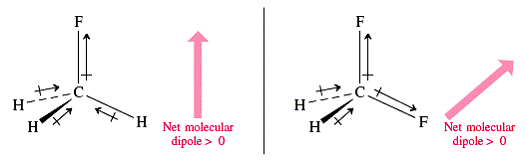
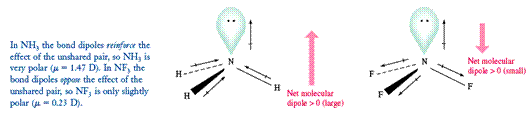
Phân tử cùng hóa trị thường có mức giá trị m = 0 ¸ 4 D, m càng mập phân tử càng phân rất mạnh.
v Tính định hướng: để tạo links cộng hóa trị bền, tỷ lệ e vùng xen phủ nên lớn, chính vì như vậy các AO lúc xen phủ đề nghị theo một hướng xác minh trong ko gian. Điều này quyết định tính định hướng của links cộng hóa trị: góc link và làm nên phân tử.
1) Thuyết lai hóa (Hybrid theory):
Trong những trường hợp, độc nhất là các phân tử cùng hóa trị bao gồm từ 3 nguyên tử trở lên, các nguyên tử trung trung ương không sử dụng các orbital nguyên tử hóa trị đơn thuần s, p, d, f để sản xuất liên kết. Trước khi chế tạo liên kết, bọn chúng trộn lẫn các AO hóa trị vào nội cỗ nguyên tử lại hình thành những AO mới rồi mới dùng những AO new này tạo links cộng hóa trị với các nguyên tử khác. Hiện tượng này điện thoại tư vấn là sự lai hóa các AO hóa trị, những AO thu được sau thời điểm lai hóa hotline là AO lai hóa (hybrid orbital).
2)
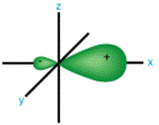
*Sự lai hóa chỉ xảy ra trong nội bộ một nguyên tử.
*Số AO lai hóa thu được = số AO thâm nhập lai hóa.
*Mỗi một AO lai hóa có ngoại hình hai khối cầu biến dị tiếp xúc nhau: 1 không nhỏ và 1 rất nhỏ (mật độ electron dồn hẳn về một khối ước (làm tăng mật độ electron khi tạo liên kết, liên kết sẽ bền hơn):
*Các AO lai hóa có hình trạng và năng lượng hệt nhau nhau và phân bố một giải pháp đối xứng nhất trong ko gian.
*Các AO lai hóa chỉ có thể tạo được loại links cộng hóa trị tuyệt nhất là links sigma (σ) mà thôi.
3) Điều kiện để lai hóa bền:
*Các AO hóa trị gia nhập lai hóa phải gồm mức năng lượng xấp xỉ gần nhau (TD: AO 2s chỉ có thể tham gia lai hóa với AO 2p mà quan trọng lai hóa cùng với 3p, 3d…)
*Các AO hóa trị gia nhập lai hóa phải gồm mật độ electron đầy đủ lớn.
Từ đk trên dẫn cho hai hệ quả sau:
· trong bảng tuần hoàn, theo chu kì khi đi từ bỏ trái lịch sự phải, khả năng lai hóa giữa s và p của các nguyên tố sút dần (vì sai biệt mức năng lượng của nhì phân lớp hóa trị ns và np tăng dần)
· vào bảng tuần hoàn, theo phân nhóm bao gồm khi đi từ bên trên xuống tài năng lai hóa sút dần (vì size AO tăng làm mật độ e giảm).
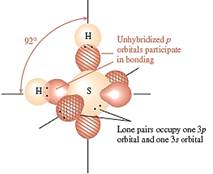
TD: H2O ( O lai hóa sp3); H2S; H2Se; H2Te (S, Se, Te ko lai hóa)
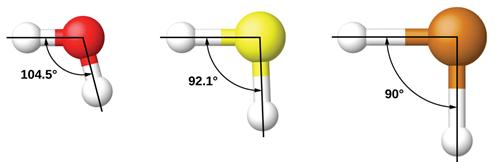
H2O H2S H2Te
4) Các dạng hình lai hóa:
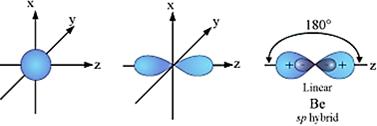
a) Lai hóa sp:
*Công thức lai hóa: 1AO s + 1AO phường → 2AO sp (góc 1800 , mặt đường thẳng)
*Có trong số chất: BeH2, BeX2, CO2, C2H2 (chất bao gồm C≡C(N) hoặc ═C═)
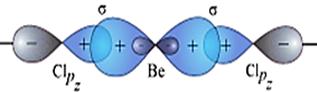
b) Lai hóa sp2:
*Công thức lai hóa: 1AO s + 2AO p → 3AO sp2 (góc 1200, trục của tam giác đều)
*Có trong những chất: BH3, BX3, C2H4,
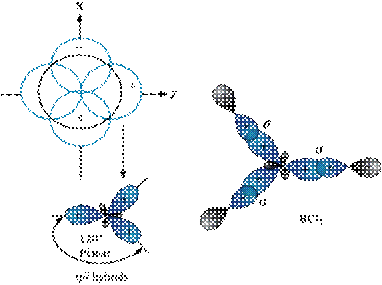
c) Lai hóa sp3:
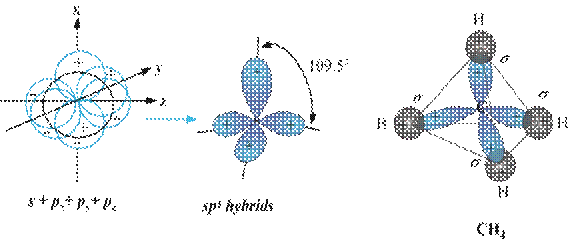
*Công thức lai hóa: 1AO s + 3AO p → 4AO sp3 (góc 109,50, trục của tứ diện đều)
*Có trong những chất: CH4 (ankan), SiH4, CX4, NH4+, SO42-, NH3, H2O…
*Ngoài ra còn tồn tại các dạng hình lai hóa không giống như: sp3d (lưỡng tháp tam giác, PCl5); sp3d2 (bát diện các = lưỡng tháp vuông, SF6); sp3d3 (lưỡng tháp ngũ giác, IF7)...
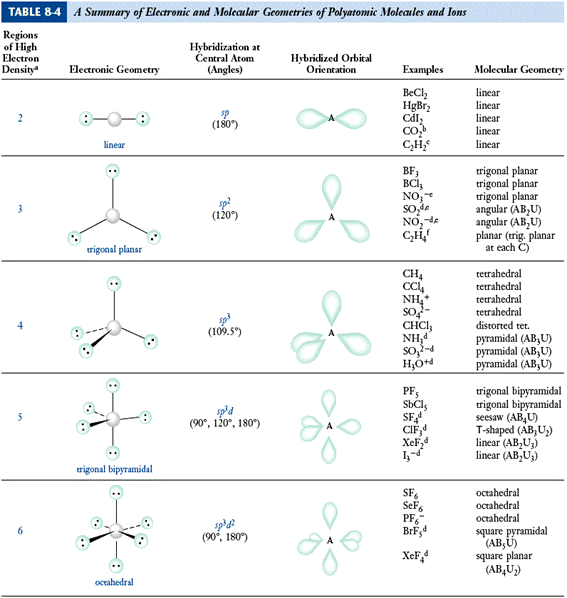 |
Ø các kiểu lai hóa và cấu hình không gian phân tử cùng góc liên kết:
Ø Dự đoán tâm trạng lai hóa của nguyên tử trung tâm A vào phân tử ABn:
§ Cách 1: Góc liên kết thực nghiệm có mức giá trị gần với góc của phong cách lai hóa làm sao thì nguyên tử trung trung khu sẽ lai hóa giao diện đó.
TD:
¨ CO2 (OĈO = 1800) => C lai hóa sp.
¨ SO2 (OŜO = 119,50) => S lai hóa sp2.
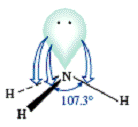
¨ NH3 (HNH = 107,30) => N lai hóa sp3.
¨ H2O (HÔH = 104,50) => O lai hóa sp3…
Cách 2: Phép thay thế sửa chữa nguyên tử: hoàn toàn có thể thay thay một nguyên tử trong một phân tử đã biết cấu hình không gian bởi một nguyên tử khác thuộc phân team với nó thì cấu hình cũng gần giống như nhau. (đối cùng với nguyên tử trung tâm chỉ nên cách nhau 1 chu kỳ, quan trọng đặc biệt đối với nguyên tử biên rất có thể thay nuốm H bằng các nguyên tử halogen X cùng ngược lại)
· CO2 (thẳng hàng); tương tự là: CS2, …
· CH4, SiH4, CCl4, SiF4 (tứ diện đều); CH3Cl, CH2Cl2, CHCl3, CF2Cl2(tứ diện lệch)
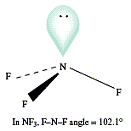
· NH3, PH3, NF3, PCl3 ( tháp tam giác)
Cách 3: Tính số phối trí SN (Steric Number) (thực chất là số AO lai hóa) của nguyên tử trung trung khu (nttt) (= số AOLH link + số AOLH không liên kết)
SN = n + ½ k
* n: số nguyên tử biên ( số nguyên tử link trực tiếp cùng với nttt).
* ½k : số song e tự do không link của nttt ( k = số e tự do)
* k = x ± y – z .
Với: x: số e lớp ngoài cùng của nttt.
y: số e mất tuyệt nhận tương ứng với năng lượng điện ion (nếu là ion).
z : số e cần thiết để các nguyên tử biên đạt thông số kỹ thuật của khí trơ ngay gần nó.
Kết quả:
.SN = 2 → A ở trạng thái LH sp → góc 1800 ( thẳng hàng)
.SN = 3 → A nghỉ ngơi trạng thái LH sp2 → góc 1200 ( trục tam giác đều)
.SN = 4 → A nghỉ ngơi trạng thái LH sp3 → góc 109028’( trục tứ diện đều)
.SN = 5 → A sinh hoạt trạng thái LH sp3d ( trục lưỡng tháp tam giác)
.SN = 6 → A ở trạng thái LH sp3d2 ( trục chén diện đều)
· CO2: SN = 2 + ½(4-2×2) = 2 => C (sp).
· SO2: SN = 2 + ½(6-2×2) = 3 => S (sp2).
· NH3: SN = 3 + ½(5-3) = 4 => N (sp3).
· H2O : SN = 2 + ½(6-2) = 4 => O (sp3).
· NH4+: SN= 4 + ½(5-1-4)=4 => N (sp3).
· SO42-: SN= 4 + ½(6+2-8) = 4 => S(sp3).
· NO2: SN = 2 + ½(5-4) = 2,5 ≈ 3 => N (sp2), (vì 1e lẻ loi vẫn yêu cầu chiếm 1 AOLH)